2019年8月欧美药品上市报告
来源:药智网/小二

本报告重点资讯
➢本月有84种药品获得美国FDA批准上市,其中10种为中国药企申报;
➢本月有24种人用药品在欧盟获批上市。
一、美国FDA药品上市概述
本月通过FDA(美国食品药品监督管理局)审批上市的药品共计84种,由于篇幅限制,本文只列举中国药企在8月获得FDA审批上市的药品,共计10种,详情见下表。
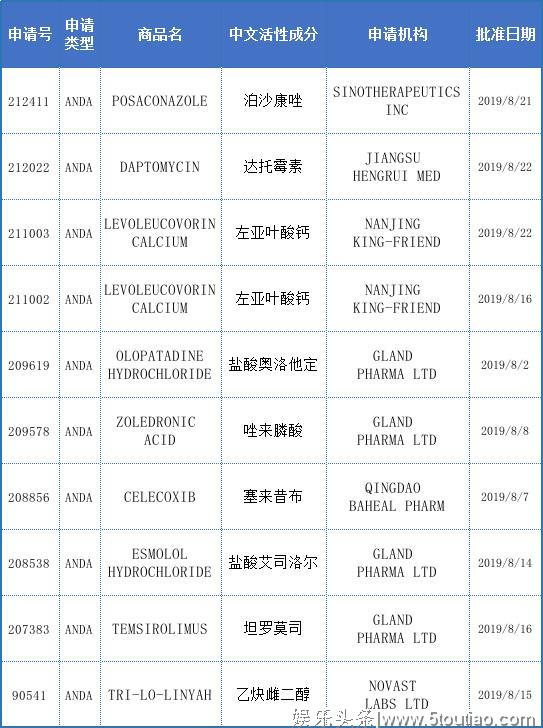
本月中国药企获FDA批准上市的药品数量排行
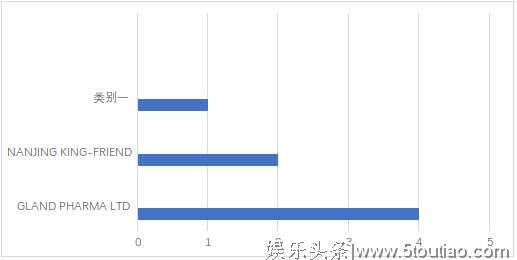
备注:类别一包含的企业有上海宣泰医药、江苏恒瑞医药、青岛百洋制药和南通联亚药业。值得注意的是,本月中国药企在FDA获批上市的药品数量中排行第一的企业是GLANDPHARMALTD(有4种)。GLANDPHARMALTD是印度首家获得美国FDA批准的注射剂药品生产制造企业,获得了全球各大法规市场的GMP认证。2016年,该企业已被上海复星医药收购。
二、欧盟药品上市概述
本月在欧盟获批上市的药品中,通过EMA集中审批上市的仅1种,药物名称为阿扎胞苷。阿扎胞苷是核苷胞苷的化学类似物,存在于DNA和RNA中,主要用于骨髓增生异常综合征的治疗。阿扎胞苷主要是通过两种机制而具有抗肿瘤活性:在低剂量下,通过抑制DNA甲基转移酶,导致DNA的低甲基化;在高剂量时,直接通过对异常骨髓造血细胞的DNA和RNA的细胞毒性,导致异常细胞死亡。
通过HMA分权和互认可审批共有23种药物,主要分布在降高血压,广谱抗菌,以及男性勃起功能障碍和乙肝抗病毒等治疗领域,详情见下表(列举部分)。
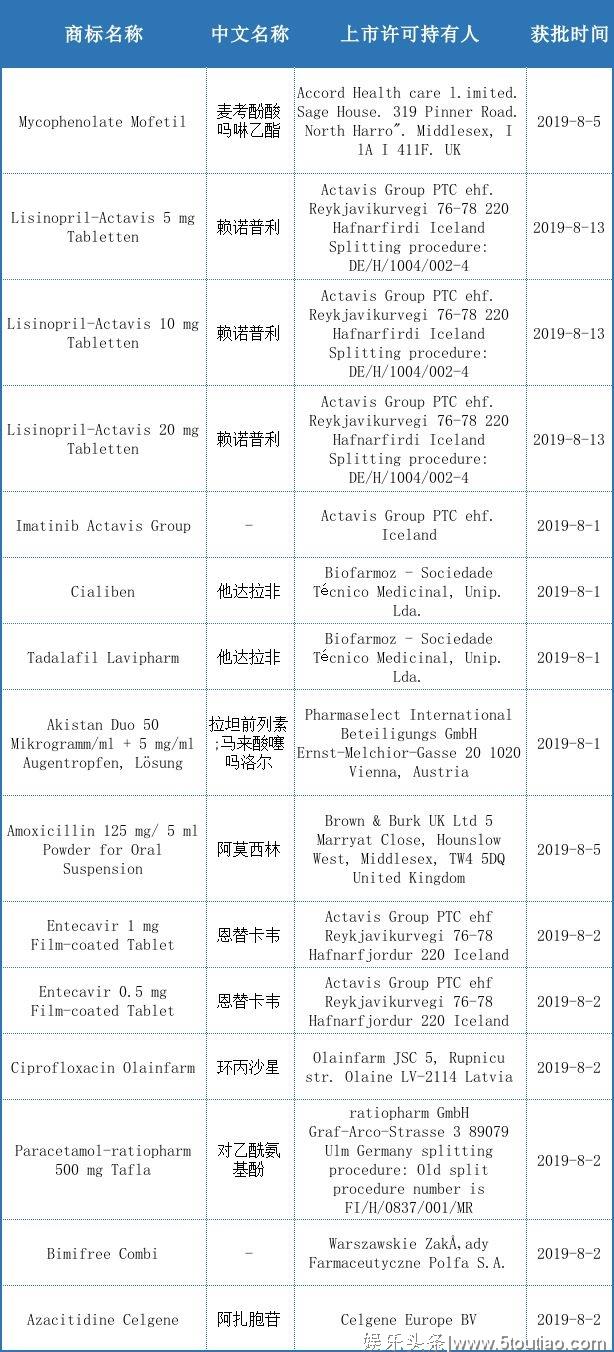
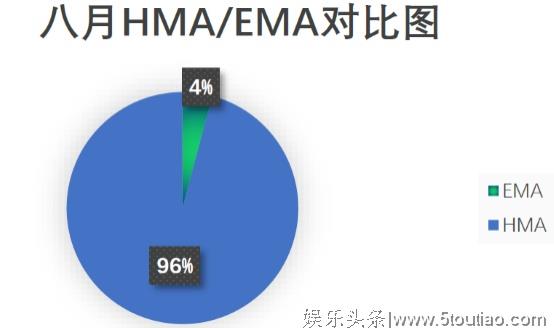
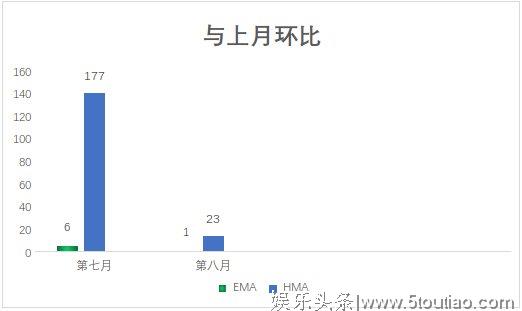
与七月上市数量相比,八月下降了86.9个百分点,且通过HMA审批上市的药品种数在欧盟整体上市情况中占比始终大于EMA,这跟上市药品所治疗的领域有关。欧盟药品局(EMA)负责集中程序(CP)申请的审批;药品局总部(HMA)负责协调分权程序(DCP)和互认可程序(MRP)申请的审批。
含有用于治疗以下疾病的新活性成分的药品,必须通过集中程序审批:
艾滋病、癌症、神经退行性疾病、糖尿病、病毒性疾病、自身免疫疾病和其他免疫缺陷疾病、罕见病用药。
以下药品必须通过集中程序审批:
◇通过生物技术工艺如基因工程制备的药品;
◇前沿治疗药品,如基因治疗、体细胞治疗或组织工程治疗药品。
数据来源:
药智欧盟(美国)药品上市数据库、FDA/EMA/HMA门户网站
通过以下方式可获取报告更多详细内容:
1、复制链接在浏览器打开网站咨询药智客服:https://vip.yaozh.com/service;
2、致电服务热点400-678-0778;
3、药智_欧盟上市药品数据库链接(企业版):https://vip.yaozh.com/epyp;
药智_美国上市药品数据库链接(企业版):https://vip.yaozh.com/fdadrug;